Was nützen Krebsmedikamente?
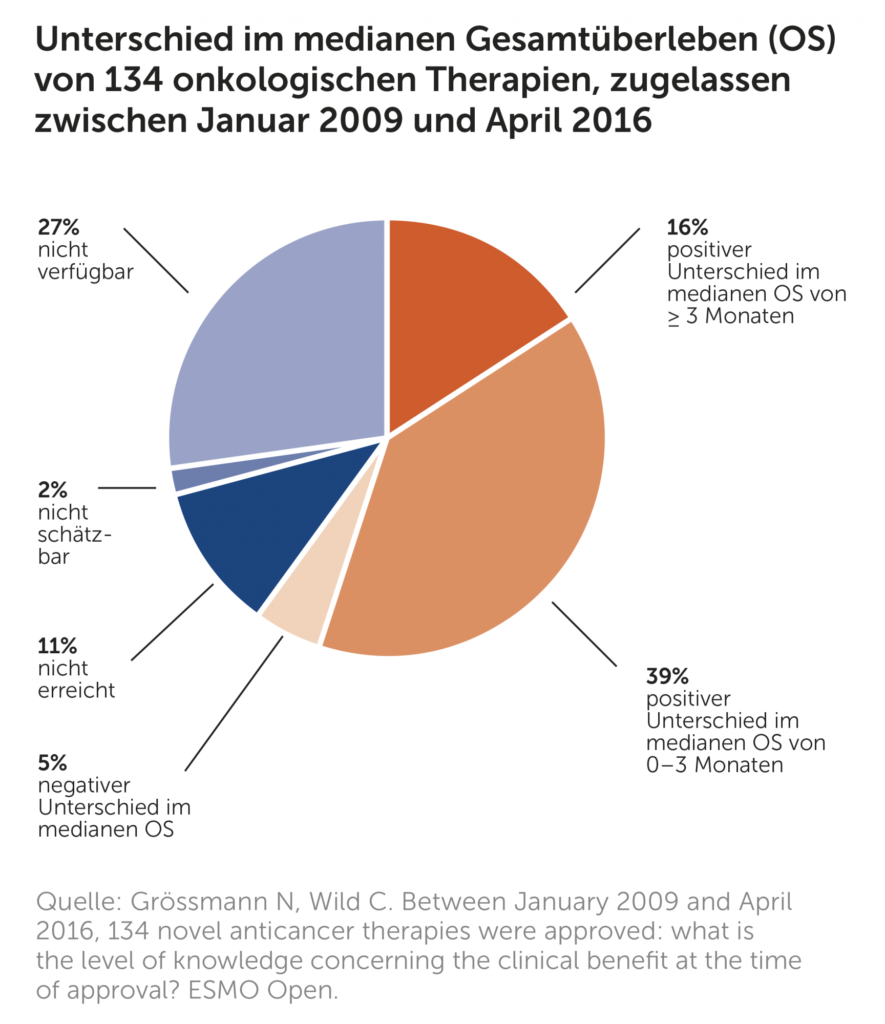
In den vergangenen Jahren nahm die Anzahl beschleunigter Zulassungsverfahren für Arzneimittel in Europa stark zu [1–3]. Dies führt nicht nur zu einem rascheren Einsatz dieser Medikamente, sondern auch zu zunehmenden Unsicherheiten hinsichtlich des klinischen Nutzens zum Zeitpunkt der Zulassung. Eine Querschnittsanalyse des Ludwig Boltzmann Instituts für Health Technology Assessments (LBI-HTA) zeigt: Onkologika (Krebsmedikamente), die in den Jahren 2009 bis 2016 zugelassen wurden, weisen in 40% der Fälle keine Informationen zum Studienendpunkt «medianes Gesamtüberleben» auf. 39% der onkologischen Therapien bringen eine Lebensverlängerung von 0–3 Monaten, 5% «verkürzten» gar das mediane Gesamtüberleben, und bei nur 16% lag eine Lebensverlängerung von über 3 Monaten vor (vgl. Abbildung) [4].
Die Vergütung von Arzneimitteln im Einzelfall
Die Art. 71a–71d KVV sollen Lösungen ermöglichen. Nämlich, dass die Krankenversicherer in Ausnahmefällen entsprechende Medikamente vergüten können. Diese ursprünglich sinnvolle und pragmatische Regelung ist aus dem Ruder gelaufen. Wie weiter?

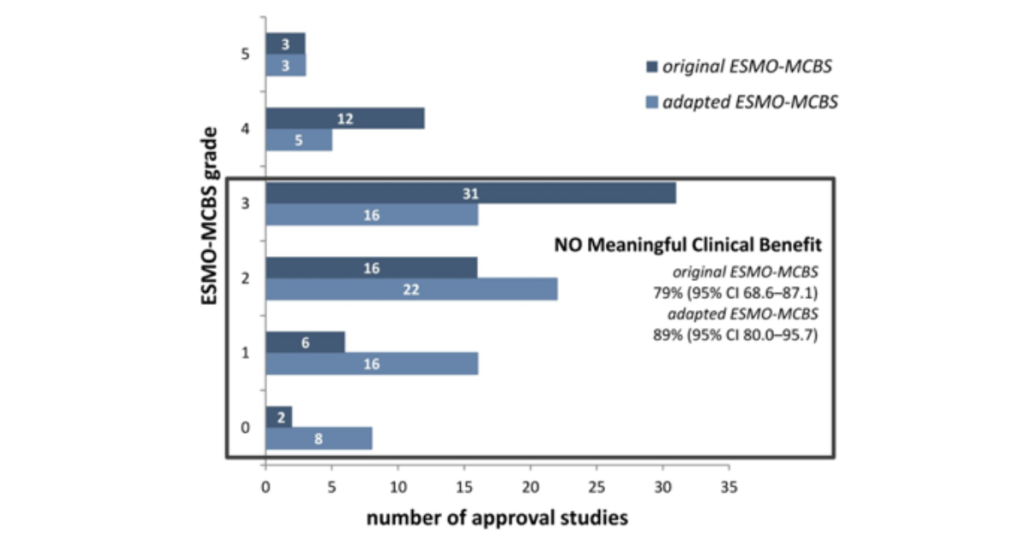
Häufig dienen lediglich umstrittene Surrogat-Endpunkte als Zulassungsbasis. Sehr vereinfacht ausgedrückt, wird hier lediglich erhoben, ob eine Wirkung erzielt werden kann, aber nicht, ob sich diese überhaupt (positiv) auf die Sterblichkeit auswirkt. Das senkt zwar die Kosten von Studien aufgrund kürzerer Laufzeiten und geringerer Patientenanzahlen. Allerdings erhöht sich so die Unsicherheit hinsichtlich des tatsächlichen Nutzen-Risikos von Arzneimitteln [5]. Die internationale Kritik am geringen Nutzen von Onkologika (bei oft sehr hohen Kosten!) führte dazu, dass nicht nur Kostenträger und HTA-Institute, sondern auch Krebsgesellschaften, unter anderem die European Society for Medical Oncology (ESMO), Instrumente für die Bewertung des klinischen Nutzens entwickelten [6–8]. Obwohl die Skala der ESMO – Magnitude of Clinical Benefit Scale (MCBS) – bereits Nebenwirkungen und Lebensqualität berücksichtigt, wurde dies in einer adaptierten Version für die Verwendung im HTA-Bereich forciert, um patientenrelevanten Endpunkten höhere Bedeutung zukommen zu lassen [8, 9]. In einer Studie des LBI-HTA aus dem Jahr 2017 wurden siebzig Therapien für die Behandlung von soliden Tumoren untersucht. Diese Therapien wurden durch die europäische Arzneimittelbehörde (EMA) zwischen 2011 und 2016 zugelassen [10]. Davon erreichten lediglich 21% den Schwellenwert für «meaningful clinical benefit» (MCB), ermittelt mit der Originalskala, und gar nur 11% der Arzneimittel mittels der adaptierten Version.
Es ist anzunehmen, dass die Anforderungen der EMA-Zulassung aufgrund der steigenden Anzahl beschleunigter Zulassungsverfahren sinken werden. Deshalb sollte regelmässig der klinische Nutzen onkologischer Therapien erhoben werden, um die gerechte Verteilung von limitierten Gesundheitsressourcen zu gewährleisten.
Referenzen
- Banzi R, Gerardi C, Bertele V, Garattini S. Approvals of drugs with uncertain benefit-risk profiles in Europe. European journal of internal medicine. 2015;26(8):572-84.
- Vella Bonanno P, Ermisch M, Godman B, Martin AP, Van Den Bergh J, Bezmelnitsyna L, et al. Adaptive Pathways: Possible Next Steps for Payers in Preparation for Their Potential Implementation. Frontiers in pharmacology. 2017;8:497.
- Grössmann N, Robausch M, Rosian K, Wild C, Simon J. Monitoring evidence on overall survival benefits of anticancer drugs approved by the European Medicines Agency between 2009 and 2015. European Journal of Cancer. 2019;110:1-7.
- Grössmann N, Wild C. Between January 2009 and April 2016, 134 novel anticancer therapies were approved: what is the level of knowledge concerning the clinical benefit at the time of approval? ESMO Open. 2016;1(6):esmoopen-2016-000125.
- Kim C, Prasad V. Cancer Drugs Approved on the Basis of a Surrogate End Point and Subsequent Overall Survival: An Analysis of 5 Years of US Food and Drug Administration Approvals. JAMA internal medicine. 2015;175(12):1992-4.
- Cohen D. Cancer drugs: high price, uncertain value. BMJ. 2017;359:j4543.
- Schnipper LE, Davidson NE, Wollins DS, Tyne C, Blayney DW, Blum D, et al. American Society of Clinical Oncology Statement: A Conceptual Framework to Assess the Value of Cancer Treatment Options. Journal of Clinical Oncology. 2015;33(23):2563-77.
- Cherny NI, Sullivan R, Dafni U, Kerst JM, Sobrero A, Zielinski C, et al. A standardised, generic, validated approach to stratify the magnitude of clinical benefit that can be anticipated from anti-cancer therapies: the European Society for Medical Oncology Magnitude of Clinical Benefit Scale (ESMO-MCBS). Annals of Oncology. 2016;28(11):2901-5.
- Wild C, Grossmann N, Bonanno PV, Bucsics A, Furst J, Garuoliene K, et al. Utilisation of the ESMO-MCBS in practice of HTA. Annals of oncology : official journal of the European Society for Medical Oncology. 2016;27(11):2134-6. Epub 2016/10/30.
- Grössmann N, Del Paggio JC, Wolf S, Sullivan R, Booth CM, Rosian K, et al. Five years of EMA-approved systemic cancer therapies for solid tumours-a comparison of two thresholds for meaningful clinical benefit. European journal of cancer (Oxford, England : 1990). 2017;82:66-71.




